miércoles, 3 de noviembre de 2010
FIEBRE AFTOSA
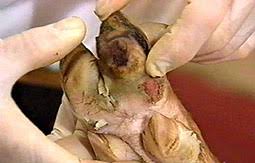
Definición: La Fiebre aftosa (FA) es una enfermedad altamente contagiosa, que ataca casi exclusivamente a los animales de pezuña hendida, domésticos y salvajes. Se caracteriza por la formación de vesículas o ampollas y erosiones en la mucosa bucal y nasal externa (especialmente en el hocico de los cerdos), y en la piel situada por encima y en medio de las pezuñas; también suelen afectarse otras áreas como los pezones.
PESTE PORCINA O CLASICA
ETIOLOGÍA
Clasificación del agente causal
Virus de la familia Picornaviridae, género Aphthovirus.
Siete serotipos inmunológicamente distintos: A, O, C, SAT1, SAT2, SAT3, Asia1
Siete serotipos inmunológicamente distintos: A, O, C, SAT1, SAT2, SAT3, Asia1
Resistencia a la acción física y química
| Temperatura: | Preservado por refrigeración y congelación y progresivamente inactivado por temperaturas superiores a 50°C |
| pH: | Inactivado a pH <6,0 o >9,0 |
| Desinfectantes: | Inactivado por hidróxido de sodio (2%), carbonato de sodio (4%), y ácido cítrico (0,2%). Resistente a los yodóforos, a los compuestos cuaternarios de amonio, hipoclorito y fenol, especialmente en presencia de materia orgánica |
| Supervivencia: | Sobrevive en los ganglios linfáticos y la médula ósea con pH neutro, pero se destruye en los músculos a pH <6,0, es decir después del rigor mortis. Puede persistir en forraje contaminado y en el medio ambiente hasta un mes, según la temperatura y el pH |
EPIDEMIOLOGÍA
- Una de las enfermedades animales más contagiosas, que causa importantes pérdidas económicas
- Baja tasa de mortalidad en animales adultos, pero a menudo alta mortalidad en los jóvenes debido a la miocarditis
Huéspedes
- Bóvidos (bovinos, cebúes, búfalos domésticos, yaks), ovinos, caprinos, porcinos, todos los rumiantes salvajes y suidos. Los camélidos (camellos, dromedarios, llamas, vicuñas) tienen baja susceptibilidad
Transmisión
- Contacto directo o indirecto (infección por gotitas)
- Vectores animados (humanos, etc.)
- Vectores inanimados (vehículos, artefactos)
- Virus aerotransportado, especialmente en zonas templadas (hasta 60 km sobre la tierra y 300 km sobre el mar)
Fuentes de virus

- Animales en período de incubación y clínicamente afectados
- Aire expirado, saliva, heces y orina; leche y semen (hasta 4 días antes de los síntomas clínicos)
- Carne y productos derivados en que el pH se mantuvo por encima de 6,0
- Portadores: en particular los bovinos y el búfalo acuático; animales convalecientes y vacunados expuestos (el virus persiste en la orofaringe hasta 30 meses en los bovinos o más tiempo en el búfalo, 9 meses en los ovinos). El búfalo del Cabo africano es el principal huésped de mantenimiento de serotipos SAT
Distribución geográfica
La fiebre aftosa es endémica en partes de Asia, Africa, el Oriente Medio y América del Sur (focos esporádicos en zonas libres de la enfermedad)
Para más información sobre la distribución geográfica véanse los últimos números de Sanidad Animal Mundial y el Boletín de la OIE
DIAGNÓSTICO
El período de incubación es de 2-14 días
Diagnóstico clínico
Bovinos
- Pirexia, anorexia, escalofríos, reducción de la producción de leche durante 2-3 días, luego:
- chasquido de labios, rechinamiento de dientes, babeo, cojera, pateo o coceo: causados por vesículas (aftas) en las membranas de las mucosas bucales y nasales y/o entre las pezuñas y la banda coronaria
- después de 24 horas: ruptura de las vesículas, que deja erosiones
- también pueden aparecer vesículas en las glándulas mamarias
- La recuperación suele producirse en un plazo de 8-15 días
- Complicaciones: erosiones de la lengua, superinfección de las lesiones, deformación de los cascos, mastitis y disminución permanente de la producción de leche, miocarditis, aborto, muerte de animales jóvenes, pérdida de peso permanente, pérdida del control térmico ("jadeo")
CIRCOVIRUS PORCINO
etiologia:
Los circovirus porcinos pertenecen a la familia Circoviridae, género circovirus. Es un virus sin envoltura, esférico, de simetría icosaédrica, y de pequeño tamaño, 17 nm, los virus vertebrados más pequeños conocidos. Posee una molécula de ADN circular simple, en forma de anillo, de ahí su nombre, de 1,7 kpb. Hasta el momento se han descrito dos tipos antigénicamente distintos ,el PCV1 y PCV2.
El genoma de los circovirus porcinos es estructuralmente muy similar con una longitud de 1759 nucleótidos para PCV1 y 1767 nucleótidos para PCV2. Estudios comparativos de secuencias del genoma de diferentes aislados de PCV1 y PCV2 han puesto de manifiesto la existencia de importantes diferencias entre ambos, presentando una homología de secuencia inferior al 80%. Se han identificado distintas faces de lectura abierta en el genoma viral. Los ORF1 y ORF2 son los más estudiados y caracterizados. En PCV2 se han descrito entre 6 y hasta 11 ORFs potenciales. Para PCV1 se han identificado hasta la fecha hasta 7 ORFs.
Epidemiología
Todavía falta mucho por entender sobre la epidemiología de los diferentes síndromes asociados al PCV2. El PMWS y el PDNS se han diseminado mundialmente a través de países productores de cerdo en los últimos 5 años y su diseminación parece estar asociada con el movimiento de animales afectados y la introducción de estos a piaras libres de ésta enfermedad.
Debido a que el antígeno o ácido nucleico del PCV tipo II ha sido identificado consistentemente en lesiones de cerdos afectados por PMWS o PDNS, el PCV2 es ahora generalmente reconocido como un importante factor en la presentación de éstos síndromes.Todavía falta mucho por entender sobre la epidemiología de los diferentes síndromes asociados al PCV2. El PMWS y el PDNS se han diseminado mundialmente a través de países productores de cerdo en los últimos 5 años y su diseminación parece estar asociada con el movimiento de animales afectados y la introducción de estos a piaras libres de ésta enfermedad.
Diferentes síndromes asociados al PCV2
Afecta cerdos de entre 5 y 12 semanas de edad. La morbilidad y mortalidad son variables y pueden llegar a ser arriba del 50%, pero son típicamente menores al 10%.
Los 6 fundamentales signos clínicos en este síndrome son pérdida de peso corporal, aumento de nódulos linfoides, diarrea, palidez e ictericia.
Las lesiones microscópicas de este síndrome incluyen depleción de células linfoides, inflamación granulomatosa de órganos linfoides, neumonía intersticial, hepatitis linfohistiocítica periportal con necrosis hepatocelular, infiltración linfohistiocítica en mucosa de estómago, ciego y colon con edema de submucosa , y nefritis intersticial linfohistiocítica con perivasculitis no supurativa.
causantes:
PCV2 causado la apoptosis en el bazo, los ganglios linfáticos y de los parches de Peyer infectados ratones BALB / c, como se ha confirmado por la luz y electrónica de morfología microscópica, así como por el ensayo de TUNEL positiva y detección de caspasa 3 activada. Anteriormente, PCV2 ácido nucleico se habían detectado en el citoplasma y raramente en el núcleo de putativo histiocitos en centros folicular. En las secciones seriadas de tejido linfoide, histiocitos putativo folicular en centros que fueron positivos para activar la caspasa 3 también fueron positivos para PCV2 ácido nucleico. En cambio, no PCV2 se detectó ácido nucleico en células apoptóticas en los sinusoides del bazo de los ratones infectados PCV2.
Pruebas morfológicas de la apoptosis PCV2 se detectó en ratones infectados, pero no en el control de ratones que habían sido inoculadas con el cultivo de tejidos líquido. Sin embargo, RPAs de bazo de los ratones de control demostró apenas niveles detectables de caspasa 3 mRNA. Estos datos representan más probable es que algunos "basal" nivel de la apoptosis implicados en la morfogénesis y la homeostasis de los tejidos linfoides que no se aprecia microscópicamente.
El mecanismo de la apoptosis inducida por PCV2 en ratones es desconocida. Un posible mecanismo podría ser el efecto directo de un PCV2 codificada en la proteína del virus de infectados y no infectados espectador células. Los virus utilizan diversas estrategias para inducir o inhibir la apoptosis como un mecanismo para mejorar la replicación. Chicken anemia virus (ChAV), miembro de la familia de Circoviridae Circoviridae, codifica una de 14 kDa prolina ricos en proteína denominada apoptin que causa la apoptosis en el timo linfoblastos, intra y extra-hemocytoblasts sinusoidal, y células reticulares. Expresión de apoptin cultivadas induce la apoptosis en las células mononucleares de pollo transformado en el pollo y timocitos, células que son susceptibles a la infección con el ChAV, pero no en fibroblastos de embrión de pollo, que no son susceptibles a la infección con ChAV. Apoptin también induce la apoptosis y tumorigénicos transformado en células humanas en cultivo, pero no induce la apoptosis en las células normales diploides humanas. La apoptosis inducida por p53-apoptin es independiente, sino que requiere la activación de la caspasa. En las células normales, apoptin se localiza principalmente en el citoplasma, mientras que en las células transformadas se encuentra en el núcleo. Una proteína específica codificada por PCV2, similar a apoptin, podría provocar la apoptosis detectado en órganos linfoides de PCV2 ratones infectados. Hasta la fecha, el 11 de los posibles marcos de lectura abierta (ORF) se han identificado en el genoma de PCV2, con seis ORFs codificación de las proteínas más grandes putativo de 6 kDa. La función de las proteínas codificadas por putativo de la otra ORFs 4 a 6 de PCV2 es desconocida. Sólo ORF1 y ORF2 se han indicado para codificar el origen de la replicación y la reproducción de una proteína asociada a y una proteína estructural respectivamente. ORF2 de PCV2 comparte una base muy conservadas N-terminal de la región que es similar a los principales problemas estructurales ChAV proteína que se encuentra en ORF3 recientemente se ha caracterizado como proteínas no estructurales, que no es esencial para la replicación de PCV2 en células cultivadas PK15 y desempeña un papel importante en la apoptosis inducida por el virus en cultivos celulares mediante la activación de la caspasa iniciadora-8 y la caspasa-3 efector vías.
prevension:
En general se cree que la infección por el PCV2 ocurre en forma subclínica en el 100% de los cerdo de destete y engorda. Sin embargo la manifestación clínica parece ser inducida por factores predisponentes.
La coinfección con el parvovirus porcino (PPV) y el virus del síndrome respiratorio y reproductivo porcino (PRRSV) ha sido comprobado. Por tanto el control de la enfermedades asociadas al PCV2 debe enfocarse también al control de estas enfermedades.
La siguiente es una lista de los principales factores en los que se debe de enfocar cualquier programa de control de enfermedades asociadas al PCV2.
La coinfección con el parvovirus porcino (PPV) y el virus del síndrome respiratorio y reproductivo porcino (PRRSV) ha sido comprobado. Por tanto el control de la enfermedades asociadas al PCV2 debe enfocarse también al control de estas enfermedades.
La siguiente es una lista de los principales factores en los que se debe de enfocar cualquier programa de control de enfermedades asociadas al PCV2.
· Coinfecciones.
· Inadecuada limpieza y desinfección.
· No manejar todo dentro/ todo fuera.
· Tamaños muy grandes de corrales.
· Vacunación/ estímulo del sistema inmune.
· Sobrepoblación.
· Pobre calidad de aire.
· Inadecuado o excesivo manejo de donaciones de lechones, resultando en una pobre protección calostral.
· Estrés en el transporte.
Tratamiento:
La mortalidad en cerdos afectados suele ser alta, pero con una adecuada atención y cuidados puede reducirse en un 50% Los tratamientos deben de realizarse a la par de un rápido diagnostico de animales enfermos y preparación de éstos del resto de la población.
El tratamiento profiláctico con acetaminofen por vía oral en granjas con problema crónico de PMWS, ha demostrado reducir la mortalidad en forma significativa.
Una novedoso tratamiento, la
sero terapia, ha tenido resultados prometedores en hatos severamente afectados.
La mortalidad en cerdos afectados suele ser alta, pero con una adecuada atención y cuidados puede reducirse en un 50% Los tratamientos deben de realizarse a la par de un rápido diagnostico de animales enfermos y preparación de éstos del resto de la población.
El tratamiento profiláctico con acetaminofen por vía oral en granjas con problema crónico de PMWS, ha demostrado reducir la mortalidad en forma significativa.
Una novedoso tratamiento, la
sero terapia, ha tenido resultados prometedores en hatos severamente afectados.
martes, 2 de noviembre de 2010
BRONQUITIS AVIAR
La bronquitis infecciosa aviar es una enfermedad respiratoria aguda, altamente contagiosa, causada por un virus del género Coronavirus. Se han identificado varios serotipos: Massachusetts, Arkansas, Connecticut, Delaware, entre otros. El virus afecta el aparato respiratorio, el sistema reproductor y algunas cepas afectan el sistema renal, aumentando la mortalidad en aves jóvenes. La enfermedad se presenta en forma abrupta, diseminándose rápidamente entre las aves, pudiéndose observar los primeros síntomas a las 48 horas post-infección. Generalmente, la bronquitis infecciosa afecta 100% de las aves y aunque la mortalidad es baja, ésta puede alcanzar más de 25% en casos complicados con patógenos secundarios como Escherichia coli, o enfermedades recurrentes como micoplasmosis, sobre todo cuando la condición inmunológica de las aves es baja. Enfermedad vírica aguda de la gallina, que produce signos respiratorios, problemas renales (broilers) y Alteraciones en la puesta
• Disminución de la calidad de los huevos: huevos en fárfara, con la cáscara rugosa y deformada, clara Acuosa. • Disminución de la incubabilidad (10-20%) • Presencia de “falsas ponedoras”. • Aumento del índice de transformación en broilers |
| |
La bronquitis aviar tiene síntomas parecidos a los de la coriza, para diferenciarla de esta podemos observar que los animales tienen tos y estornudos, además de emitir ruido al respirar. Produce diarreas acuosas, en algunas ocasiones blanquecinas; las plumas están erizadas y los huevos se tornan deformes y con la cáscara frágil o exenta de calcio. |
• Virus RNA pleomórficos, con envoltura y proyecciones glicoproteínas
• Sensibles al calor y a la mayoría de desinfectantes
• Antígeno común por ELISA
• Más de 50 serotipos por SN:
• Massachusetts M-41 (respiratorio, ovario), Connecticut, Arkansas
• Australia T (oviducto, aparato renal), Gray y Holte (renal).
• Cepas europeas (Dutch) D207; D212 (oviducto)
• Cepas 4/91.
• Emergencia de nuevos serotipos
Cultivo del virus:
Cultivo del virus:
• Embrión de pollo: enanismo, embolamiento, plumas rizadas, espesamiento de la MCA.
• Cultivos de células renales: sincitios y vacuolización.
• Cultivo de anillos traqueales: ciliostasis.
PATOGENIA:
Periodo de incubación: 18-36 horas.
• Vía de entrada:
• Aerógena: multiplicación en tráquea, sacos aéreos o pulmón
• Digestiva: multiplicación en mucosa del proventrículo
• Viremia corta y multiplicación en:
• Células epiteliales del aparato respiratorio.
• Según cepa de virus y edad del ave: oviducto y riñón.
• Bolsa de Fabricio, tonsilas cecales y cloaca.
• Evolución en 10-14 días.
• Inmunidad de larga duración frente a serotipo.
• Inmunidad pasiva las 2-4 primeras semanas de vida frente al serotipo homólogo.
Signos respiratorios:
<!tos, estornudos, exudados nasales y oculares, estridor, disnea.
<! Depresión, apilamiento en busca de calor, disminución del consumo de pienso, adelgazamiento.
• Morbilidad hasta el 100%, pero mortalidad baja (hasta el 30%).
• Muerte por asfixia y aplastamiento.
Lesiones:

• Inflamación catarral en tráquea, cavidad nasal y senos infraorbitarios.
• Atrofia de oviducto
• Nefritis y palidez riñones
Oviducto afectado:
A: infundíbulo
B: magnum
C: istmo
D: útero
E: vagina
Diferencial: Signos respiratorios:
• Influenza aviar: todas las especies. Cuadro con edemas y hemorragias, alta mortalidad con cepas de elevada virulencia.
• Newcastle: todas las especies. Alta mortalidad con cepas velogénicas. Signos digestivos y nerviosos.
• Laringotraqueitis: Cuadro únicamente respiratorio. Muerte por goteo (1% diario). Evolución más lenta.
• CRD (Mycoplasma gallisepticum) Aerosaculitis en pollos. Complicación frecuente.
• Coriza infeccioso (Haemophilus paragallinarum): abundante secreción nasal y ocular, conjuntivitis.
• Aspergilosis (Aspergillus fumigatus): Contaminación ambiental por esporas del Hongo. Granulado amarillo verdoso sobre sacos aéreos.
NEWCASTLE
Es una enfermedad zoonotica de aves altamente contagiosa que afecta a muchas especies de aves domésticas y silvestres. Afecta más notoriamente a las aves de corral en debido a su alta susceptibilidad y a las posibilidades de impacto severo que una epidemia causa en la industria avícola. Es endémica de muchos países. La enfermedad de Newcastle fue descubierta en Newcastle del Tyne, Inglaterra en 1926 (Doyle), pero también en esa época se encontraron cepas ligeramente diferentes en otras partes del mundo. La exposición de los humanos a las aves infectadas (por ejemplo en las plantas de procesamiento de pollo) pueden causar suaves síntomas de conjuntivitis y similares gripe, pero aparte de esto el virus NDV no significa riesgos para la salud humana. Ha surgido interés en el uso de NDV como un agente anticanceroso dada la habilidad del virus de matar selectivamente células tumorales humanas con toxicidad limitada para las células normales. No existe un tratamiento contra el NDV, pero el uso de vacunas profilácticas y medidas sanitarias reduce la probabilidad de brotes en los criaderos de aves.
Etiología:
Clasificación del agente causal
Virus de la familia Paramyxoviridae, género Rubulavirus
Temperatura: | Inactivado a 56°C/3 horas, 60°C/30 min |
pH: | Inactivado a pH ácido |
Productos químicos: | Sensible al éter |
Desinfectantes: | Inactivado por formalina y fenol |
Supervivencia: | Sobrevive durante largos períodos a temperatura ambiente, especialmente en las heces |
Epidemiologia: Huéspedes
Muchas especies de aves tanto domésticas como salvajes
Los índices de mortalidad y de morbilidad varían según las especies y en función de la cepa viral
Las gallinas son las aves de corral más susceptibles, los patos y los gansos son las menos susceptibles
Puede existir un estado portador en las psitacinas y en algunas otras aves salvajes
Muchas especies de aves tanto domésticas como salvajes
Los índices de mortalidad y de morbilidad varían según las especies y en función de la cepa viral
Las gallinas son las aves de corral más susceptibles, los patos y los gansos son las menos susceptibles
Puede existir un estado portador en las psitacinas y en algunas otras aves salvajes
Como actúa?:
La enfermedad de Newcastle no produce lesiones patognómicas macroscópicas
Varias aves deben ser examinadas para realizar un diagnóstico tentativo.
Para el diagnóstico final se debe esperar el aislamiento del virus y su identificación
Las lesiones que se pueden encontrar son:
edema del tejido intersticial o peritraqueal del cuello, especialmente cerca de la entrada torácica
congestión y algunas veces hemorragias en la mucosa traqueal
petequia y pequeñas equimosis en la mucosa del proventrículo, concentradas alrededor de los orificios de las glándulas mucosas
edema, hemorragias, necrosis o ulceraciones del tejido linfoide en la mucosa de la pared intestinal
edema, hemorragias o degeneración de los ovarios
Trasmisión:
Contacto directo con las secreciones de las aves infectadas, especialmente las heces.
Comida, agua, instrumentos, locales, vestimentas humanas, etc., contaminados
El virus no afecta a humanos, sin embargo, las personas, vehículos, equipos o herramientas, son las fuentes primarias que transportan la infección de una granja a otra.
Síntomas:
Síntomas respiratorios y/o nerviosos: jadeo y tos. Alas caídas, arrastran las patas, cabeza y cuellos torcidos, desplazamientos en círculos, depresión, inapetencia, parálisis completa.
Huevos deformados, de cáscara rugosa y fina y que contienen albúmina acuosa
Diarrea verde acuosa
La morbilidad y mortalidad dependen de la virulencia de la cepa del virus, del grado de inmunidad a la vacunación, de las condiciones ambientales y del estado de las aves de la explotación.
<! Pérdida de apetito
<! Pérdida de peso
<! Estornudos
<! Descargas nasales
<! Descargas oculares
<! Problemas respiratorios
<!Diarrea (usualmente de color amarilla y verde brillante)
<! Pérdida de coordinación
<!Espasmos
<!Cabeza oscilante
Las etapas avanzadas de la enfermedad de Newcastle pueden causar movimientos espasmódicos e involuntarios, parálisis de las patas y/o alas, contorciones del cuello, una ubicación de la cabeza poco natural y la dilatación de las pupilas de las aves. Sin embargo, no todas las aves infectadas despliegan los síntomas y éstas pueden morir repentinamente antes de desplegar los síntomas.
Lesiones:

· La enfermedad de Newcastle no produce lesiones patognómicas macroscópicas.
Para el diagnóstico final se debe esperar el aislamiento del virus y su identificación
Las lesiones que se pueden encontrar son:
edema del tejido intersticial o peri traqueal del cuello, especialmente cerca de la entrada torácica
congestión y algunas veces hemorragias en la mucosa traqueal
petequia y pequeñas equimosis en la mucosa del proventrículo, concentradas alrededor de los orificios de las glándulas mucosas
edema, hemorragias, necrosis o ulceraciones del tejido linfoide en la mucosa de la pared intestinal
edema, hemorragias o degeneración de los ovarios.
Como proteger a las aves:

No compre aves que han sido traídas de contrabando a los Estados Unidos. Esas aves no han estado en cuarentena ni han sido examinadas por el USDA, por lo que pueden ser portadoras de Newcastle Exótica u otras enfermedades.
Las aves de mascota, especialmente los pericos, pueden transmitir el virus por más de un año sin mostrar señales de la enfermedad.
Pedir a los proveedores de aves que certifiquen que las aves fueron importadas legalmente o que se criaron en Estados Unidos, aves sanas antes de enviarlas y que se transportaron en contenedores desinfectados.
Mantener registros de ventas y envíos de aves. Separe las aves nuevas que compró por lo menos por 30 días.
Prevención:
En la mayoría de países del mundo el control del Newcastle se realiza mediante programas de vacunación. Sin duda alguna, la vacuna más utilizada en el mundo es la contra Newcastle, millones de dosis de vacuna son aplicadas diariamente en la industria avícola. Las vacunas y los programas de vacunación difieren considerablemente entre los países o regiones, pero el principio básico es el de que con la vacunación, las pérdidas debidas a la enfermedad se disminuyen considerablemente.
Tratamientos:
Una vez diagnosticada, el veterinario pondrá en cuarentena a las aves infectadas y podrá realizarles la eutanasia ya que no hay tratamiento ni cura para la enfermedad. Además, todo caso sospechoso de la enfermedad de Newcastle tiene que ser reportado a las autoridades ya que la infección se disemina rápidamente en las aves de corral domésticas y esta es mortal. El virus no es evidenciado cuando las aves son vacunadas y puestas en cuarentena. Por consiguiente, las aves nuevas importadas a los Estados Unidos tienen prohibido estar vacunadas.
Vacunas
Existen vacunas a virus vivo o activo, lo mismo que vacunas con virus inactivado. Las vacunas a virus vivo comprenden vacunas preparadas con cepas clasificadas como lento génicas, que tienen muy poca capacidad de producir la enfermedad en casos sin complicaciones. Las cepas B1 y LaSota son quizás las más utilizadas en todo el mundo, aunque algunos países o zonas utilizan además cepas lento génicas regionales. Las cepas B1 y
LaSota inducen una reacción postvacunal de tipo respiratorio, observada con mayor intensidad con la cepa LaSota que con la B1. Generalmente se acepta que la cepa LaSota proporciona mejor protección frente a cepas velogénicas, mientras que la protección con la cepa B1 es menor, así como la reacción postvacunal respiratoria es considerablemente menor. Cepas clonadas obtenidas de la cepa LaSota se encuentran en el mercado, capaces de proporcionar una buena protección, disminuyendo la reacción respiratoria postvacunal.
La vacunación por aspersión con gota gruesa se practica a partir del día de edad. Existen gabinetes especiales diseñados para vacunar los pollos en la planta de incubación, aplicando una aspersión directamente a los pollos cuando se encuentran en las cajas de transporte. En el campo, este proceso se utiliza en empresas libres de organismos como Mycoplasma gallisepticum y M. synoviae. Aves positivas a estos agentes respiratorios pueden reaccionar fuertemente cuando se las vacuna con otros agentes de tipo respiratorio como Newcastle o bronquitis.
Esta enfermedad no tiene tratamiento, solamente se realiza prevención con vacunas con virus vivos.
CONCLUSIÓN:
Es imprescindible que las metas sanitarias alcanzadas se sostengan y que los sistemas de vigilancia que se desarrollan en la avicultura intensiva se extiendan a otro tipo de explotaciones. El conocimiento detallado de las poblaciones avícolas y su distribución geográfica resulta vital.
La eficacia de los sistemas veterinarios, los planes de erradicación y prevención, los programas de control para otras enfermedades, así como la elaboración de planes de contingencia resultan elementos claves en los mecanismos de control.
Suscribirse a:
Entradas (Atom)